
COMUNIDADE FÚNGICA DOS INOCULANTES OBTIDOS PELA TÉCNICA ON-FARM EM SÍTIOS DENTRO DE DUAS ÀREAS DE MINERAÇÃO DE FERRO¶
Clique no botão abaixo para alternar visualização:
Emanuelle Burgos Cardoso1
Paulo Prates Júnior2
Bruno Coutinho Moreira4
Marliane de Cássia Silva Soares3
Eduardo Gusmão Pereira5
Maria Catarina Megumi Kasuya1
Resumo¶
O objetivo deste estudo foi caracterizar, por meio do sequenciamento da região ITS rDNA, a comunidade de fungos em inoculantes. A técnica on-farm foi utilizada para obtenção dos inoculantes de fungos micorrízicos arbusculares (FMA) a partir dos sítios de revegetação (RV) e nativo (NT) da Mina da Retiro das Almas (Vale S.A.), desativado há 10 anos, que foram enriquecidos ou não com esporos da Coleção Internacional de Cultura de Glomeromycota, da Fundação Universidade de Blumenau: Nativo mix (NM) e revegetação mix (RM). A contagem de esporos de FMA revelou que não houve diferença na quantidade de esporos entre os diferentes inoculantes. Foi observada maior similaridade de OTU fúngico entre N e \text{N} ~ + \text{CICG}, onde foram observados os maiores números de OTUs compartilhadas, mesmo com a introdução de espécies em N + CICG. O sequenciamento da região ITS evidenciou a abundância do filo Ascomycota, seguido pelo filo Basidiomycota.
Palavras-chave: Fungos; Inoculantes microbianos; Pós-mineração.
1. Introdução¶
A avaliação do sucesso da recuperação pode ser avaliada pela ocorrência e distribuição da comunidade da microbiana edáfica, que é regulada pelas interações entre as disponibilidades de C e nutrientes (Sheoran et al., 2010). Assim, o papel crítico exercido pelas comunidades microbianas para o progresso da reabilitação em áreas de mineração tem sido reconhecido (Claassens et al., 2010).
A inoculação com microrganismos é considerada benéfica e necessária para a restauração ecológica de ecossistemas terrestres perturbados e para conduzir o desenvolvimento da comunidade vegetal (Wang et al., 2017). A relação simbiótica entre fungos micorrízicos arbusculares (FMAs) e as raízes de plantas resulta no aumento da aquisição de nutrientes e na tolerância a estresse biótico e abiótico (Asmelash et al., 2016).
A técnica on farm consiste na multiplicação de FMAs e de microrganismos associados, que visa a produção de inoculante micorrízico para aplicações no campo (Schlemper e Stürmer, 2014). Propágulos de FMAs como esporos, hifas, fragmentos de raízes de plantas colonizadas são adicionados diretamente ao substrato (Ijdo et al., 2011; Schlemper e Stürmer, 2014). O método on-farm para a obtenção de propágulos de FMA pode ser conduzido em condições naturais ou mesmo controladas, com uma única espécie ou um consórcio de espécies de FMAs selecionados, e com uma grande variedade de substratos (Gaur et al., 2000; Douds et al., 2005; Ijdo et al., 2011). Além disso, o método on-farm pode ser realizado em potes ou vasos de mudas de tamanhos variados ou ainda, em caixas elevadas, o que o torna econômico (Millner & Kitt,1992; Douds et al., 2005, Moreira et al., 2019).
O objetivo deste estudo foi caracterizar a comunidade de fungos dos inoculantes obtidos pela técnica on-farm, por meio do sequenciamento da região ITS rDNA, pela plataforma Illumina Miseq.
2. Material e Métodos¶
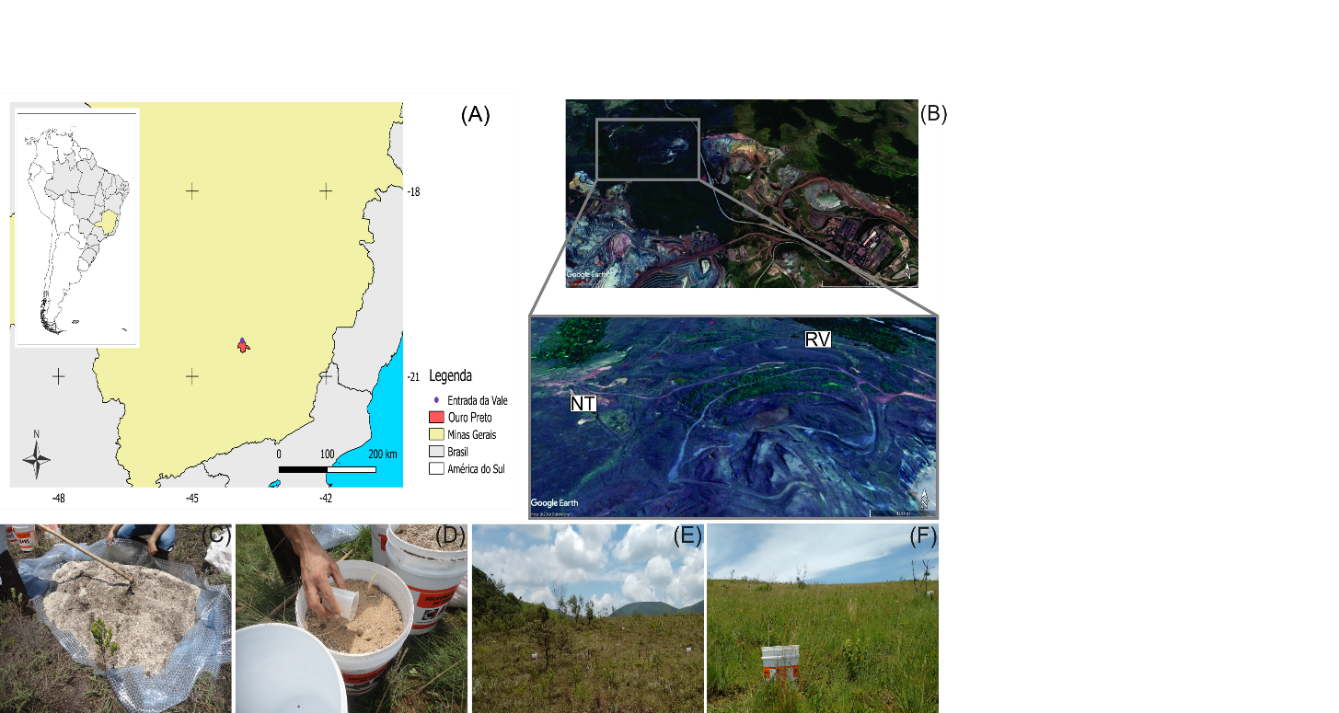
Os inóculos de FMAs obtidos pela metodologia on-farm foram provenientes da mina Retiro das Almas, pertencente à Companhia Vale S. A., descomissionada há cerca de dez anos. Essa mina está situada ao sul da região do Quadrilátero Ferrífero, no município de Ouro Preto, estado de Minas Gerais, Brasil (Fig. 1, A). O clima da região é subtropical úmido de acordo com a classificação de Köpper (Alvares et al., 2014). A média anual de chuvas é de 1.386 mm, com a estação chuvosa de outubro a março e a estação seca de abril a setembro. A média anual de temperatura é de 20,1 °C.
Dois sítios dentro da mina, distantes entre si 350 m foram utilizados para obtenção de inoculantes de FMA in situ, por meio da técnica on-farm: um sítio de pilha de estéril, onde ocorreu a extração de ferro e posteriormente foi revegetado (RV) (S 20º24'09,7'' W 43º52'02.9''), e um sítio de referência, com vegetação nativa, não perturbado por mineração (NT) (S 20º24'17.1'' W 43º54'15.8'') (Fig. 1, B).
O preparo da técnica on-farm foi realizada nos sítios em dezembro de 2015, que corresponde à estação chuvosa. Para a obtenção de inoculantes de FMAs pela metodologia on-farm foram utilizados baldes de 18 L com orifícios, para permitir o fluxo de água e contato com o solo. Cada balde continha uma mistura de vermiculita, bagaço de cana fresco e solo de cada sítio, nas proporções (1:1:1, vv). Os tipos de inóculos on-farm obtidos a partir do sítio RV foram: nativo do sítio de revegetação (R), nativo do sítio de revegetação mix (inóculo R + CICG). No sítio de referência, com vegetação nativa, os inóculos on-farm obtidos foram: nativo do sítio de referência (N) e nativo mix (N + CICG), com quatro repetições para cada tratamento, em delineamento inteiramente casualizado (DIC), totalizando 16 baldes.
Os inóculos mistos foram constituídos de esporos das espécies: Rhizophagus clarum} (10.250 esporos), _Glomus etunicatum (13.000 esporos) e Gigaspora albida (300 esporos) obtidos da Coleção Internacional de Cultura de Glomeromycota (CICG), da Universidade Regional de Blumenau, Santa Catarina, Brasil. Cada balde recebeu 20 sementes de sorgo, e após 11 meses (outubro 2016) foram retirados do campo. A contagem de esporos foi realizada para cada tratamento, de acordo com a técnica de peneiramento úmido (Gerdemann & Nicolson, 1963) para estimar as quantidades de esporos em cada inoculante.
Para a contagem de esporos de FMAs obtidos pelo método on-farm e índices de diversidade da comunidade fúngica em cada inoculante foram realizadas análises de variância (ANOVA), seguida do teste de Tukey (p < 0,05).
Figura 1: Localização da Mina Retiro das Almas. (A) Município de Ouro Preto, onde está situada a mina, (B) Sítios RV e NT, de onde foram originados os inóculos.
2.2 Sequencimento e análise da comunidade fúngica nos inoculantes¶
O sequenciamento de DNA total foi realizado pela plataforma Illumina MiSeq (2 x 250 bp), utilizando os primers da região ITS: ITS1f (5′- CTTGGTCATTTAGAGGAAGTAA -3′) e ITS2 (5′- GCTGCGTTCTTCATCGATGC -3′). As sequências foram analisadas utilizando o Quantitative Insights into Microbial Ecology (QIIME, version 1.17) (Caporaso et al., 2010) de acordo com a pipeline} implementada pelo Brazilian Microbiome Project (BMP) (Pylro _et al., 2014). A análise de coordenadas principais (PCoA) foi gerada para visualizar as diferenças entre as comunidades fúngicas dos inoculantes, baseadas nos dados do sequenciamento e calculadas a partir da matriz Bray-Curtis usando os pacotes: Vegan, phyloseq and ggplot2 no software R v.3.1.3 project (R Development Core Team., 2015).
3. Resultados e discussão¶
3.1. Quantidade de esporos de FMAs dos inoculantes}¶
As médias de esporos de FMAs nos inoculantes não diferiram (p-valor = 0,166), e as médias variaram de 176 a 289. Os inoculantes provenientes da técnica on-farm, no sítio R apresentaram esporos em quantidades comparáveis aos inoculantes provenientes do sítio de referência N, até mesmo nos inoculantes mistos, onde espécies de FMAs foram adicionadas. Essa distribuição equitativa de esporos pode estar relacionada tanto a multiplicação de esporos, instrínseca a própria técnica on-farm, quanto ao estágio de recuperação do sítio RV e época do ano em que o on-farm foi recolhido.
3.2 Caracterização da comunidade fúngica dos inoculantes¶
A PCoA distinguiu a comunidade fúngica entre os sítios de origem (RV e NT), dos inoculantes de FMA obtidos pelo método on-farm. Foi observada maior similaridade entre N e N+CICG, o que evidenciou o maior número de OTUs compartilhadas, mesmo com a introdução de espécies nos inóculos mistos.
Do total de sequências, os filos mais representativos em todos os inoculantes de FMA obtidos pelo método on-farm foram Ascomycota com: 82,01% em R, 54,13% em R+CICG, 70,21% em N, 51,15% em N+CICG. Basidiomycota foi o segundo filo mais abundante em todos os inóculos com 19,65% em N+CICG, 5,09 % em N, 3,37% em R+CICG e 1,39% em R.
Embora o método on-farm vise a multiplicação de propágulos de FMAs, a presença de outros grupos de fungos foi previsível, devido a própria composição dos substratos no on-farm e a condição in situ, na qual o método é empregado. Assim, o sequenciamento da região ITS rDNA evidenciou a abundância e diversidade da comunidade fúngica nos inoculantes.
4. Considerações finais¶
Os esporos de FMAs foram quantificados com uma média similar em todos os inóculos. A técnica de sequenciamento utilizada mostrou que a comunidade fúngica dos inóculos foi distinguida a partir dos sítios de origem de obtenção do inóculo e os filos Ascomycota e Basidiomycota foram os mais abundantes em todos os inóculos.
5. Agradecimentos¶
Departamento de Microbiologia Agrícola da UFV, Laboratório de Associações micorrízicas da UFV, FAPEMIG, CAPES e VALE S.A.
Referências Bibliográficas¶
ALVARES, C.A., STAPE, J.L.; SENTELHAS, P.C.; GONÇALVES, J.L.M.; SPAVOREK, G. Köppen's climate classification map for Brazil. Meteorologische Zeitschrift, v.22, p.711--728, jan 2014.
ASMELASH, F.; BEKELE, T.; BIRHANE, E. The potential role of arbuscular mycorrhizal fungi in the restoration of degraded lands. Frontiers in Microbiology, Addis Ababa, v. 7, p. 1--15, jun. 2016.
CAPORASO, J.G.;KUCZYNSKI, J.; STOMBAUGH, J.; BITTINGER, K.; BUSHMAN, F.D.; COSTELLO, E.K.; FIERER, N. et al. QIIME allows analysis of high-throughput community sequencing data, Nature Methods, Colorado, v.7, n. 5, p. 335-336, mai. 2010.
CLAASSENS, S.; VAN RENSBURG, P.J.; LIEBENBERG, D. A Comparison of microbial community function and structure in rehabilitated asbestos and coal discard sites. Water, Air & ; Soil Pollution, Potchefstroom, v. 223, p.1091--1100, ago. 2012.
DOUDS, D. D.; NAGASHI, G.; PFEFFER, P.E.; KAYSER, W.M.; REIDER, C. On-farm production and utilization of arbuscular mycorrhizal fungus inoculum. Canadian Journal Plant Science, Wyndmoor, v.85, n. 1, p. 15-21, 2005.
GERDEMANN, J.W. & NICOLSON, T.H. Spores of mycorrhizal Endogene Extracted from Soil by Wet Sieving and Decanting. Transactions of the British Mycological Society, v. 46, n.2, p. 235-244, 1963.
GAUR, A., ADHOLEYA, A., MUKERJI, K.G. On-farm production of VAM inoculum and vegetable crops in marginal soil amended with organic matter. Journal of Tropical Agriculture, New Delhi, v. 77, p.21-26, 2000.
IJDO, M.; CRANENBROUCK, S.; DECLERK, S. Methods for large-scale production of AM fungi: past, present, and future. Mycorrhiza, Louvain-la-Neuve, v. 21, n. 1, p.1--16, jan. 2011.
MILLNER, P.D.; KITT, D.G. The Beltsville method for soilless production of vesicular arbuscular mycorrhizal fungi, Mycorrhiza, Beltsville, v. 2, p.9-15, 1992.
MOREIRA, B.C.; PRATES JUNIOR, P.; JORDÃO, T.C.; SILVA, M.C.S.; RIBEIRO, A.P.F.; STURMER, S.L.; SALOMÃO, L. C. C. et al. Effect of Inoculation of Pineapple Plantlets with Arbuscular Mycorrhizal Fungi Obtained from Different Inoculum Sources Multiplied by the On-Farm Method. Revista Brasileira de Ciências do solo, Viçosa, v. 43, mai. 2019.
PYLRO, V.S.; ROESH, L.F.W.; ORTEGA, J.M.; AMARAL, A.M.; TÓTOLA, M.R.; HIRSCH, P.R. et al. Microbial Ecolology, Viçosa, v. 67, n.2, 237-241, fev. 2014.
SCHLEMPER, T.R. & STURMER, S.L. On farm production of arbuscular mycorrhizal fungi inoculum using lignocellulosic agrowastes. Mycorrhiza, Blumenau, v. 24, p. 571--580, abr. 2014.
SHEORAN, V.; SHEORAN, A.S.; POONIA, P. Soil Reclamation of Abandoned Mine Land by Revegetation: A Review. International Journal of Soil, Sediment and Water, Jodhpur, v.3, n.13, p.1--21, 2010.
WANG, F. Occurrence of arbuscular mycorrhizal fungi in mining-impacted sites and their contribution to ecological restoration: Mechanisms and applications. Critical Reviews in Environmental science and Technology, Shandong Province, v. 47, n. 20, p. 1901--1957, 2017.
-
Departamento de Microbiologia agrícola, Universidade Federal de Viçosa, campus Viçosa, MG. emanuelleburgos03@gmail.com. ↩↩
-
Departamento de Microbiologia agrícola, Universidade Federal de Viçosa, campus Viçosa, MG. ppratesjunior@gmail.com ↩
-
Departamento de Microbiologia agrícola, Universidade Federal de Viçosa, campus Viçosa, MG. mcassiabio@yahoo.com ↩
-
Colegiado de Engenharia Agronômica, Universidade Federal do Vale do São Francisco, campus Petrolina, PE. bruno.moreira@univasf.edu.br ↩
-
Laboratório de Fisiologia do Estresse Abiótico, Instituto de Ciências Biológicas e da Saúde, Universidade Federal de Viçosa, campus UFV Florestal, Minas Gerais, Brazil egpereira@gmail.com ↩